学会員論文紹介
近著論文の解説
ASPSCR1::TFE3 orchestrates the angiogenic program of alveolar soft part sarcoma
田中美和 * Surachada Chuaychob 本目みずき 山崎ゆかり Ruyin Lyu 山下享子 阿江啓介 松本誠一 粂川昂平 丸山玲緒 Wei Qu 宮城洋平 横川隆司 中村卓郎 *
*責任著者
田中美和 公益財団法人がん研究会 がん研究所 がんエピゲノムプロジェクト
横川隆司 京都大学大学院 工学研究科 マイクロエンジニアリング専攻
中村卓郎 東京医科大学 医学総合研究所 未来医療研究センター 実験病理学部門
-
Nature Communications, 14: 1957, 2023.
doi: 10.1038/s41467-023-37049-z
URL: https://www.nature.com/articles/s41467-023-37049-z
論文サマリー
胞巣状軟部肉腫(alveolar soft part sarcoma, ASPS)の原因融合遺伝子ASPSCR1::TFE3(AT3)の機能とその標的遺伝子を明らかにし、ASPSの血管形成を誘導する仕組みを解明しました。ASPSは希少がんである軟部肉腫の一つで、AYA世代(思春期・若年成人)に好発します。腫瘍の増殖は緩やかですが、血管形成が盛んなことから全身に転移する傾向が強く、予後不良な疾患です。ASPSの原因融合遺伝子AT3が血管形成をはじめとする腫瘍の形質をコントロールしていることが示唆されていました。本研究グループは2017年にASPSのマウスモデルを確立して研究を進めていましたが、今回AT3蛋白質が血管形成を促進する遺伝子のスーパーエンハンサーに結合することを発見し、エピゲノム編集技術を用いて標的遺伝子を同定しました。標的遺伝子には血管形成因子自体と、それらを運ぶ細胞内輸送促進因子が含まれ、ASPSにおける独特な血管構造の原因となっていることがわかりました。さらに、マイクロ流体デバイスを使って、がんの微小環境を3次元共培養系で再現することに成功しました。今後、輸送促進因子機能を抑える全く新しい治療方法の開発にもつながる成果と期待されます。
【研究の背景】
がんの成長に伴いがん巣内での血管形成が必要になってきます。正常の血管では血管内皮細胞が周皮細胞に裏打ちされた構造をとりますが、がんの新生血管ではしばしば周皮細胞が欠如し、漏れが生じやすい不完全な血管形成が生じます。一方、がんの中にはより完全な血管構造が豊富に存在するタイプがあり、これらのがんは血行性転移が頻発する傾向を示します。ASPSはAYA世代の大腿や臀部、上腕といった深部の軟部組織に発生する悪性の肉腫で、ゆっくりとした発育態度を示します。その一方で、胞巣状構造と呼ばれる腫瘍細胞と周皮細胞に富む血管組織が一体化した病巣を形成するため、比較的早期から高頻度で肺などへの転移を示します。効果的な治療薬が未開発であり、予後不良な疾患です。ASPSはその発生起源が不明な謎の多い腫瘍でもあります。
研究チームでは、ASPSの原因遺伝子であるAT3をマウス胎児の間葉系細胞に導入したモデルを作製しましたが、このモデルではASPSに見られる胞巣状構造と肺転移が忠実に再現され、ASPSの特性の理解に役立ってきました。さらに血管形成機構や融合遺伝子機能、標的遺伝子の解明への貢献が期待されていました。
【本研究で得られた結果・知見】
SPSモデルマウスから樹立した腫瘍細胞株を継代培養していると、融合遺伝子AT3の発現がしばしば消失することから、培養条件下では融合遺伝子は不要であることが示唆されました。ところが、AT3を失った細胞をマウスに移植すると、血管形成が消失し腫瘍増殖が著しく抑制されることがわかりました。AT3は、転写因子としてスーパーエンハンサーを含むアクティブなエンハンサーに結合します。AT3の発現が消失した腫瘍細胞では血管形成に関連した遺伝子のエンハンサー機能が低下し、遺伝子発現も抑制される傾向が認められました(図1)。興味深いことに、スーパーエンハンサーの機能を抑えるBRD4阻害薬JQ1をASPS移植マウスに投与しても同様の効果が認められました。
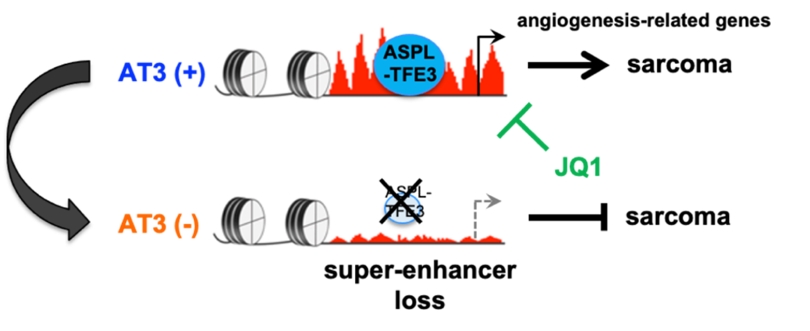
図1. AT3は血管形成関連遺伝子のスーパーエンハンサーを制御する
そこで、血管新生と生体内での腫瘍形成に関わるエンハンサーを同定する目的で、CRISPRエピゲノム編集技術を利用したスクリーニングを実施すると、Rab27a、Sytl2、Pdgfb、Vwfの4遺伝子がAT3に制御されるエンハンサーに支配されていることがわかりました。この内、Pdgfbは周皮細胞を誘引する因子として、Vwfは血管増殖因子の機能を維持する因子として機能することが示唆されています。一方で、Rab27aとSytl2は血管形成因子を含む小胞の細胞膜への輸送を促進することが知られています。今回の発見はAT3が血管形成因子の産生と分泌という血管形成を統括する機能を有することを示すとともに、がんにおける細胞内輸送経路の重要性を示したものと考えています(図2)。
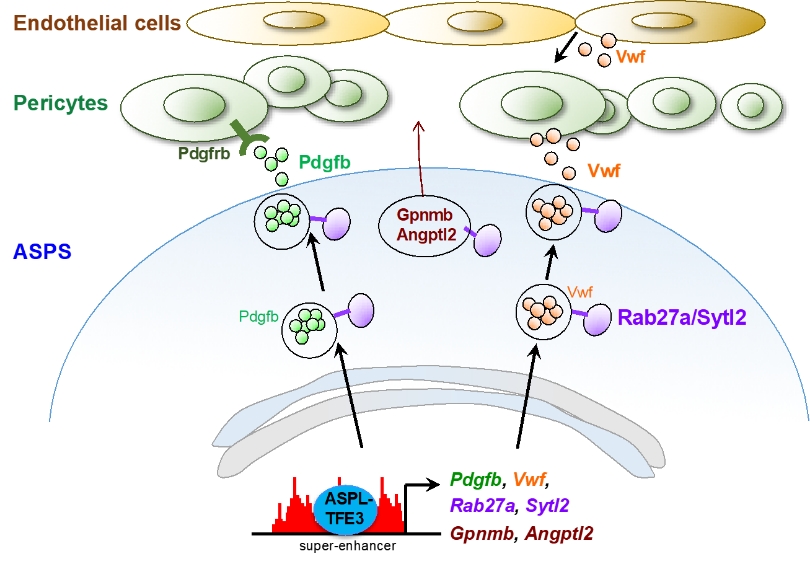
図2. AT3による標的遺伝子を介した血管新生機構
また、肺から血管内皮細胞のみを単離し、血管内皮細胞に含まれるSARS-CoV-2ウイルス遺伝子を定量したところ、加齢マウスの血管内皮細胞でより多くのウイルス遺伝子が検出され、血管内皮細胞にSARS-CoV-2ウイルスが取り込まれていることが確認されました (図3)。
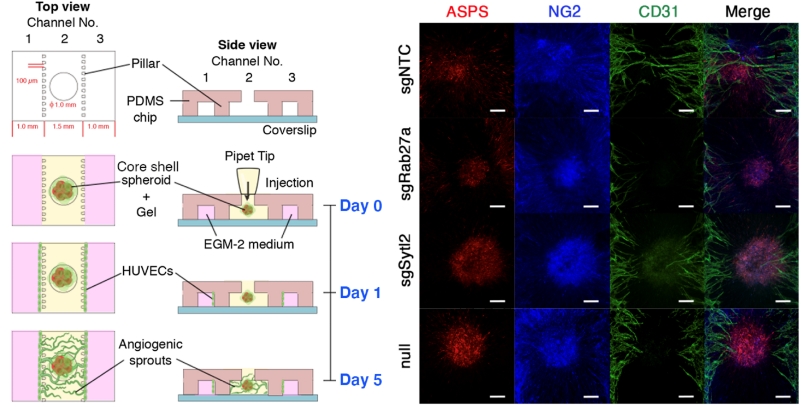
図3. マイクロ流体デバイスの仕組み(左)とASPSスフェロイドに対する血管内皮の進展効果(右)
著者コメント
ASPSは患者数も少なく、特異な病像も相まって血管形成機構や転移様式には他の多くのがん(いわゆるコモンキャンサー)とは相違点が少なくありません。しかしながら、ASPSに見られる血管構造は腎細胞がんや肝細胞がん、内分泌系腫瘍などにも認められることから、今回発見された細胞内輸送経路の亢進を介した血管形成の仕組みは、これらのがんにも当てはまることが予想されます。
今回の研究から、AT3融合遺伝子やRab27a/Sytl2の機能を阻害する全く新しい治療薬の開発が大きな意義を持つことがわかり、私たちは創薬研究を開始しています。特にRab27a/Sytl2に促進される小胞輸送をコントロールすることは、がんだけではなく好中球やT細胞が関わる炎症を抑えることもわかっていて、アレルギー疾患や敗血症などへの応用も期待されます。開発したマイクロ流体デバイスについても、創薬研究に向けた実用化を推進していきます。

公益財団法人がん研究会 がん研究所 旧発がん研究部(中村研)のメンバー
田中美和(後列左から5人目)
中村卓郎(後列左から6人目)
活用したデータベースにかかわるキーワード
がん微小環境
小胞輸送
エピゲノム編集


