学会員論文紹介
近著論文の解説
造血幹細胞ニッチを形成する新たな血管内皮細胞系譜の発見
~細胞起源の違いに依存した組織特異的血管の新規多様性創出機構~
石川 博之・中嶋 洋行
対象論文
- Endoderm-derived islet1-expressing cells differentiate into endothelial cells to function as the vascular HSPC niche in zebrafish.
- Hiroyuki Nakajima#*, Hiroyuki Ishikawa#, Takuya Yamamoto, Ayano Chiba, Hajime Fukui, Keisuke Sako, Moe Fukumoto, Kenny Mattonet, Hyouk-Bum Kwon, Subhra P. Hui, Gergana D. Dobreva, Kazu Kikuchi, Christian S. M. Helker, Didier Y. R. Stainier*, and Naoki Mochizuki* (#共同第一著者、*共同責任著者)
- Developmental Cell Vol. 58,224-238 (2023)
doi: 10.1016/j.devcel.2022.12.013.
URL:https://www.sciencedirect.com/science/article/pii/S1534580722008954?via%3Dihub
Profile著者プロフィール

済生会横浜市南部病院 循環器内科

国立循環器病研究センター研究所 細胞生物学部
論文サマリー
血管は単なる導管として働くだけではなく、組織特異的な因子(アンジオクライン因子)を発現したり、血液脳関門のような組織特異的な構造を作ったりするなど、臓器や組織ごとに多彩な役割を担うことが近年わかってきています。例えば、骨髄などの造血組織では、血管内皮細胞が組織特異的な性質を獲得することで、造血幹細胞の維持や増殖に必要な微小環境(ニッチ)を作ることが知られています。しかしながら、このような臓器や組織毎の血管内皮細胞の多様化・特殊化がどのようにして起きているのかは、ほとんどわかっていませんでした。
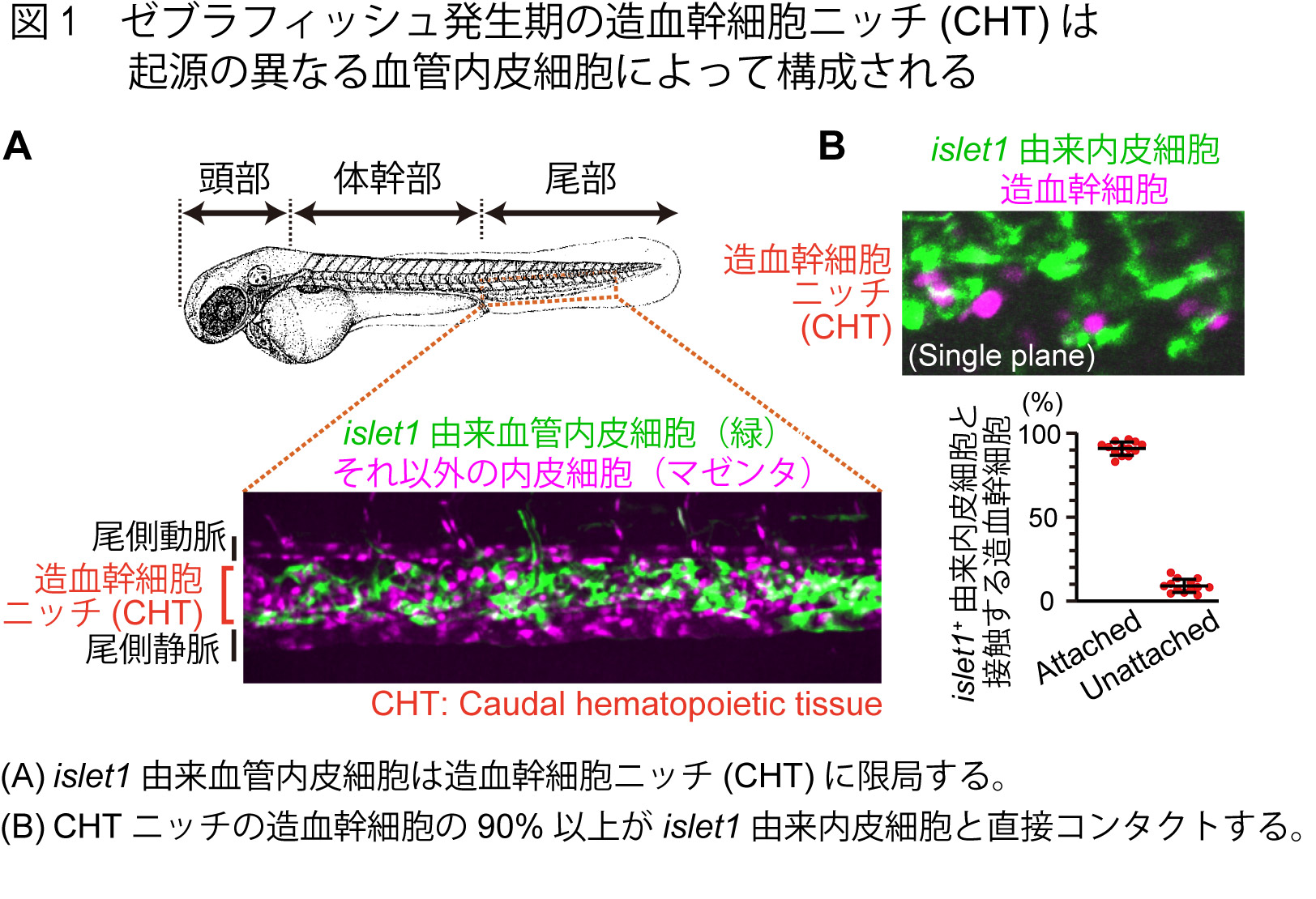
本研究では、ゼブラフィッシュを用いた最先端の生体イメージング手法と単一細胞シークエンス解析により、発生期の造血幹細胞ニッチを形成する血管内皮細胞の多くが、周囲の血管内皮細胞とは異なる細胞起源から分化することを見出し、それによって細胞起源の違いが組織特異的な内皮細胞の機能獲得に寄与することを明らかにしました。我々は、独自の遺伝子組み換え魚(トランスジェニックレポーターフィッシュ)を樹立することで、ゼブラフィッシュ発生期の造血幹細胞ニッチであるCaudal hematopoietic tissue(CHT)に存在する血管内皮細胞の多くが、転写因子islet1を発現する新規の内皮前駆細胞(islet1+内皮前駆細胞)に由来することを見出しました(図1A)。ライブイメージングによる詳細な解析により、これらのislet1由来内皮細胞が、ニッチにおける造血幹細胞の主要な足場として機能することを示しています(図1B)。
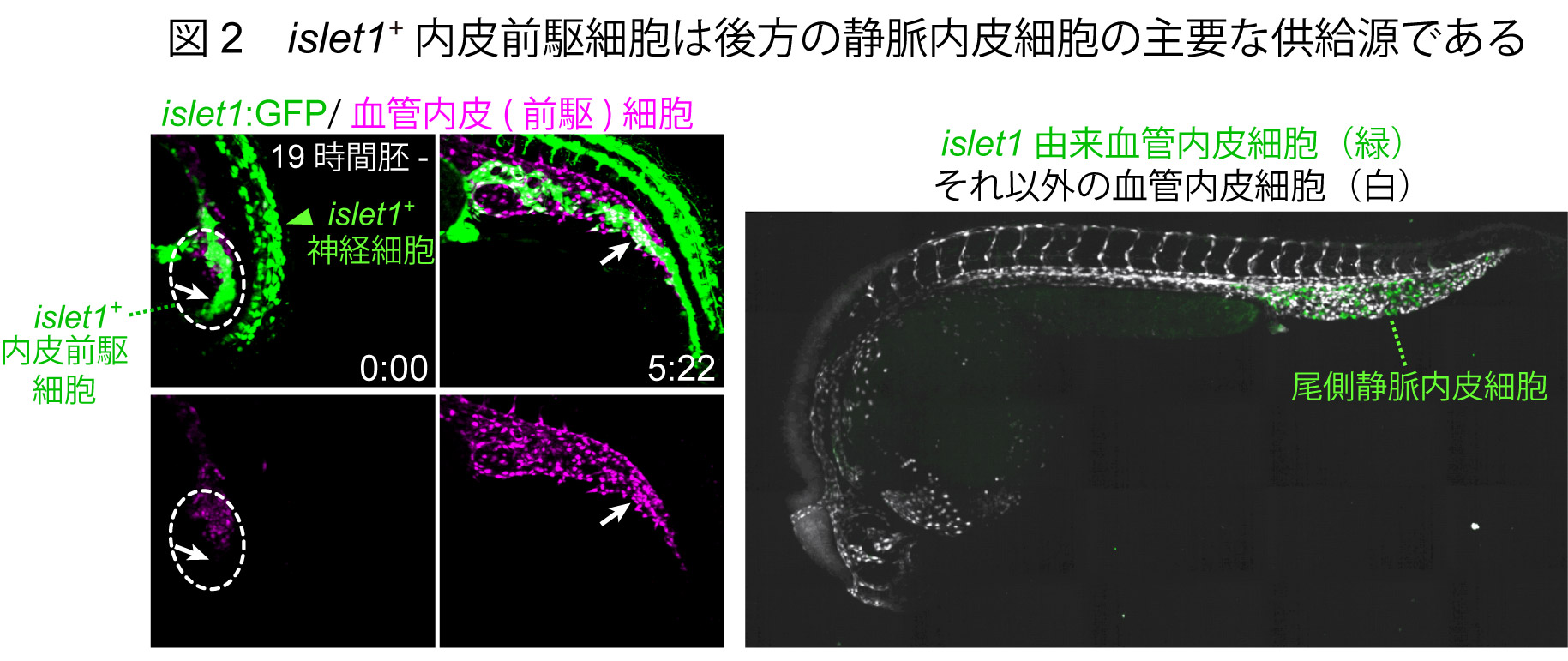
我々が同定したislet1+内皮前駆細胞の運命を、ライブイメージングによって詳細に追跡したところ、ほとんど全ての細胞が排泄腔(cloaca)より後方の静脈内皮細胞へと分化することがわかりました(図2)。これらのislet1+内皮前駆細胞は、血球や体節など内皮細胞以外の細胞には全く分化せず、最終的にはそのほとんどがCHTニッチを構成する内皮細胞に分化しました。ゼブラフィッシュでは、多能性の中胚葉細胞が、Npas4l(Cloche)というパイオニア転写因子(機能的には哺乳類のETV2に相当)を発現することで、内皮・血球系の細胞へと運命付けられることが報告されています。islet1+内皮前駆細胞もまた、Npas4l依存的にニッチ形成内皮細胞へと分化することが分かりました。一方で、islet1+内皮前駆細胞は、その出現時にはNpas4lを発現しておらず、内皮細胞へと分化する直前にNpas4l陽性となっていたことから、Npas4lの発現以前に内皮細胞へと運命付けられているという点で、内皮細胞の運命決定に関して極めて興味深い細胞集団であるといえます。
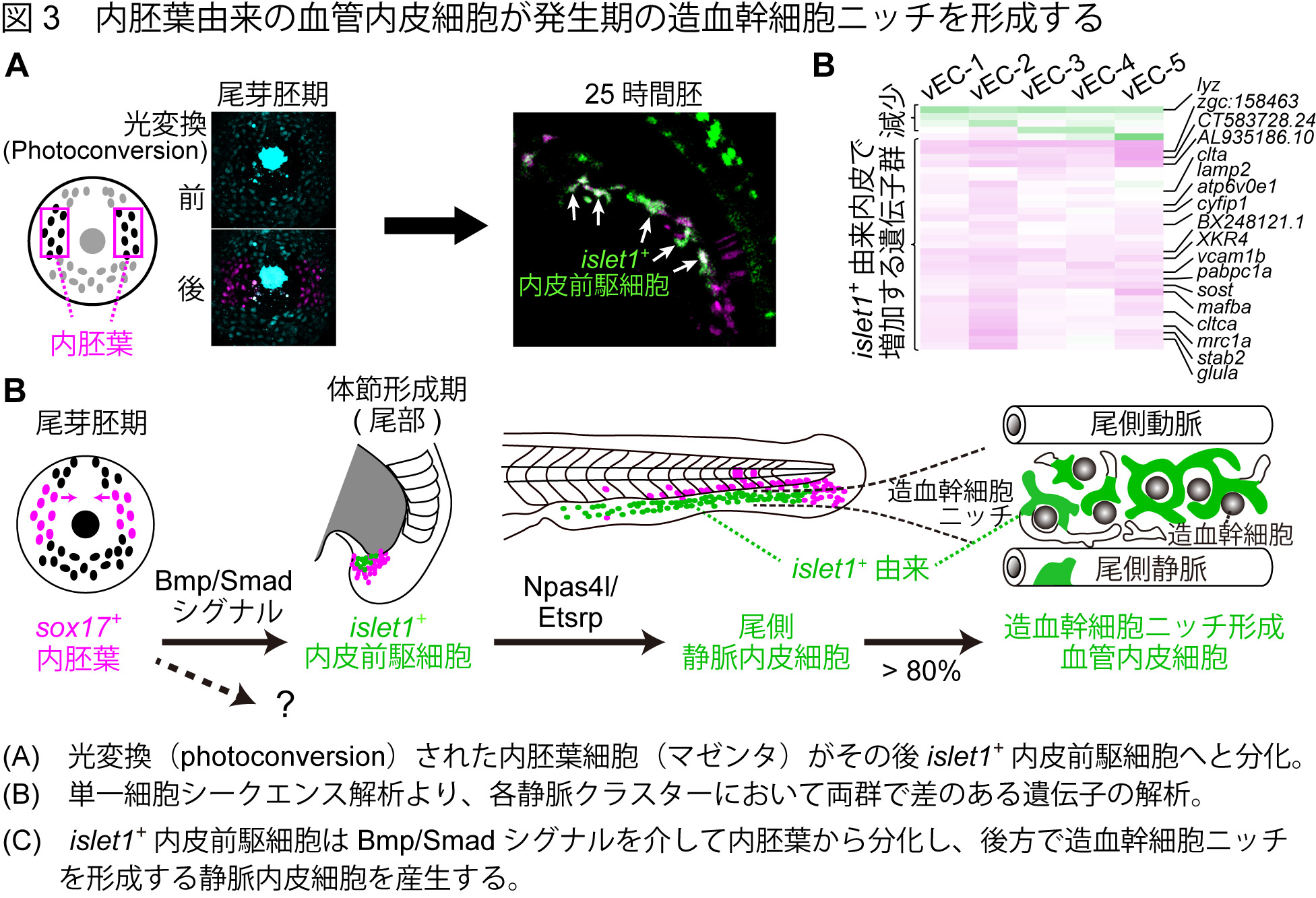
血管は、中胚葉に由来することがよく知られていますが、islet1+内皮前駆細胞がどこから来るのかを調べたところ、驚いたことに中胚葉ではなく本来は腸や肺などを作る内胚葉に由来することがわかりました。光変換(photoconversion)技術を用いた細胞系譜解析により、islet1+内皮前駆細胞が、クッパ―胞の両側に存在するsox17陽性の内胚葉細胞から分化することを明らかにしました(図3A)。さらに、内胚葉からislet1+内皮前駆細胞への分化に、Bmp/Smadシグナルが重要であることも明らかにしました。Bmp/Smadシグナルは哺乳類でも静脈分化に重要なシグナル伝達経路であることから、islet1+内皮前駆細胞が静脈内皮細胞へと細胞運命が限定されているのはBmpの影響があるのではないかと考えています。
最後に、細胞起源の違いが血管内皮細胞の多様性創出にどのように寄与するのかを遺伝子発現レベルで検討するために、単一細胞シークエンス解析を行いました。その結果、起源の異なる内皮細胞同士が、完全に混じり合って複数のクラスターを構成する一方で、各クラスターに分かれた後も、細胞起源の違いを反映した特定の遺伝子群を発現することがわかりました(図3B)。そのため、細胞起源の違いが、分化後も何らかの形で細胞に記憶されていることが強く示唆されました。このように本研究では、造血組織特異的な血管機能に、血管内皮細胞の起源の違いが重要であることを初めて明らかにしました(図3C)。
本研究は、内胚葉から血管内皮細胞が分化することを初めて実証した研究になります。内胚葉起源のislet1由来内皮細胞では、分化後も細胞起源の違いを遺伝子発現の違いとして記憶していたことから、どのようなメカニズムにより細胞起源の違いが細胞機能の違いへと反映されるのかは、今後明らかにしたい課題であると考えています。また、哺乳類でも同様の機構が保存されているのかを検討することで、造血幹細胞ニッチ機能を司る共通原理の理解にも繋げていきたいと考えています。
著者コメント
この研究はマックスプランク研究所(ドイツ)のDidier Stainier博士との国際共同研究として実施しました。Stainier博士のグループは、血管や血球が消失するcloche mutantを1995年に報告し、その後、原因遺伝子として内皮・血球系共通のマスターレギュレーターであるNpas4lを発見されました。一方で、cloche mutantでは完全に血管内皮細胞が消失する訳ではなく、胚の後方で一部の内皮細胞が残存することから、当初我々は、islet1由来の内皮細胞がclocheに依存しない後方の内皮画分を構成しているのではないかと想定してこの研究をスタートしました。結果は、(我々の多くの仮説がそうであるように)仮説通りには運ばずに、islet1由来の内皮細胞の分化もまたcloche依存的であったことから、cloche非依存的な内皮細胞の正体は今でも謎のままです。一方で我々は、islet1に由来する内皮細胞系譜が、中胚葉ではなく内胚葉に由来し、最終的に造血幹細胞ニッチを形成する内皮細胞に分化するという、当初想定していなかった興味深い結論に辿り着くことができましたので、想定外なところにこそ研究の面白さがあることを実感しました。
この研究成果は、大学院生の石川博之くんが、開始当初から彼の研究センスの良さを発揮しながら一生懸命実験を行ってくれた賜物です。投稿してからは多くの苦労があり、最初に雑誌に投稿してから約2年半の月日が掛かってしまいましたが、何とか世に出すことができ、この論文により石川君も期限内に大阪大学医学系研究科の博士号の学位を取得することができたので、ホッとしております。この研究は、単一細胞シークエンス解析を手伝ってくれた元同僚の山本拓也博士(京大)をはじめ共同研究者の皆様、ラボメンバー、支えて下さった多くの方々のお蔭で論文としてまとめることができました。最後に、日頃より多大なサポートと熱いご指導をいただいている望月直樹先生に、この場を借りて謝意を表したいと思います。
活用したデータベースにかかわるキーワード
組織特異的血管
造血幹細胞ニッチ
islet1