学会員論文紹介
近著論文の解説
Regnase-1は肺胞マクロファージにおいてIL-6及びPDGF mRNAの分解を介して肺動脈性肺高血圧症を制御する
稲垣薫克、浅野遼太郎、岡澤慎、正木豪、石橋知彦、中岡良和
対象論文
- Regnase-1 Prevents Pulmonary Arterial Hypertension via mRNA Degradation of Interleukin-6 and Platelet-Derived Growth Factor in Alveolar Macrophages
- Ai Yaku, Tadakatsu Inagaki, Ryotaro Asano, Makoto Okazawa, Hiroyoshi Mori, Ayuko Sato, Fabian Hia, Takeshi Masaki, Yusuke Manabe, Tomohiko Ishibashi, Alexis Vandenbon, Yoshinari Nakatsuka, Kotaro Akaki, Masanori Yoshinaga, Takuya Uehata, Takashi Mino, Hatsue Ishibashi-Ueda, Akio Morinobu, Tohru Tsujimura, Takeshi Ogo, Yoshikazu Nakaoka*, and Osamu Takeuchi*
* equal contribution, co-correspondence - Circulation
doi: 10.1161/CIRCULATIONAHA.122.059435
オンライン掲載日:2022年8月23日
論文サマリー
肺動脈性肺高血圧症(Pulmonary arterial hypertension: PAH)は肺動脈に原因不明の狭窄や閉塞を生じて、肺動脈圧の上昇から心不全を来す予後不良の厚生労働省指定難病です。近年の血管拡張薬の開発により予後は改善しましたが、治療不応性の症例は未だに予後が不良であり、特に膠原病性PAH(Connective tissue disease associated-PAH:CTD-PAH)は、肺動脈病変のみならず、肺静脈閉塞症や心臓の線維化を合併することが多く、他の原因によるPAHと比較して予後不良であることが知られており、その病態解明が必要とされています。
私達はマウスを低酸素(10%)環境に3週間曝露する低酸素誘発性肺高血圧症モデルの系で、低酸素により発現が誘導される炎症性サイトカインInterleukin-6(IL-6)が肺でTh17細胞を誘導し、Th17細胞に由来するInterleukin-21(IL-21)がPAH病態を促進することをPNAS誌にて2015年に報告しました。しかしながら、どのような細胞が炎症性サイトカインを産生し、PAH病態に寄与しているのかは明らかでありませんでした。
そこで我々は、免疫細胞の活性化や炎症を抑えるブレーキとしての働きを担うRegnase-1という分子に着目しました。Regnase-1は、IL-1やIL-6などの炎症性サイトカインをはじめとする免疫細胞活性化に関連するタンパク質をコードするmRNAを分解するRNaseとして機能して、免疫応答を抑制するタンパク質です。近年の研究から、ヒトの潰瘍性大腸炎患者の上皮細胞でRegnase-1の機能獲得性変異が同定されています。また、特発性肺線維症患者の気管支肺胞洗浄液中で、線維化に関連する細胞である2型自然リンパ球(ILC2) の数とRegnase-1の発現量との間に負の相関が認められ、ILC2に発現するRegnase-1が肺線維症の増悪を防ぐ機能を持つことも明らかになっています。したがって、我々はRegnase-1が炎症を抑制することでPAH病態を制御しているのではないかと考え、PAH発症・重症化でのRegnase-1の役割を検討する事にしました。
まず、肺高血圧症病態にRegnase-1が関与しているかどうか検討するために、肺高血圧症患者と健常者の末梢血単核球(Peripheral Blood Mononuclear Cells: PBMC)におけるRegase-1遺伝子発現量を比較した結果、肺高血圧症患者ではRegnase-1発現量が有意に低下し、予後と関係することが明らかになりました。次に、肺高血圧症のサブグループであるPAH患者に関して詳細に検討したところ、特にCTD-PAH患者においてRegnase-1発現量とPAHの重症度が負に相関しており、Regnase-1が肺高血圧症、特にCTD-PAHの病態に深く関与する可能性が考えられました(図1)。
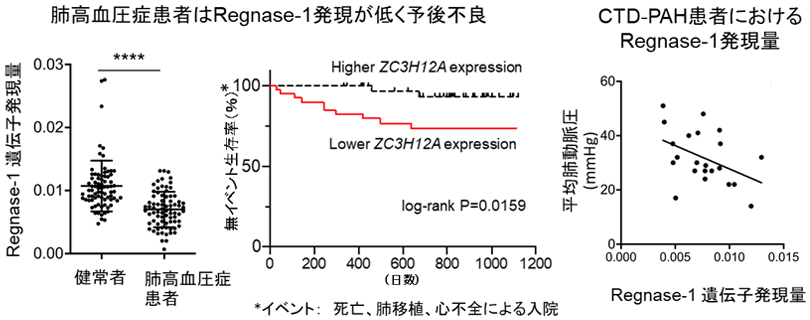
図1. 肺高血圧症患者ではPBMCにおけるRegnase-1 mRNA発現が健常者と比べて有意に低下しており、発現量が低いほど予後不良である。特に、CTD-PAH患者ではRegnase-1 mRNA発現とPAHの重症度が有意な負の相関を示す。
PAH病態に寄与すると考えられているIL-6やIL-1 などの炎症性サイトカインは免疫細胞の一種である骨髄系細胞で分泌されることが知られています。そこで、骨髄系細胞においてRegnase-1を欠損する2系統のマウス(Regnase-1f/f; CD11c-CreおよびRegnase-1f/f; LysM-Cre)を作製したところ、両系統のマウスがPAHを自然発症し、既存のPAHモデルマウスで再現することが困難であった重症PAH患者でみられる肺動脈の叢状病変 (Plexiform lesion)を呈しました。また、膠原病患者に合併することの多い肺静脈閉塞症や心臓線維化(右室だけでなく左室でも)の病理組織像が本マウスでは見られることから、重症のCTD-PAHの病態を模態するモデルマウスだと考えられました(図2)。これらの2系統のマウスでは、肺胞マクロファージにおけるRegnase-1欠損が共通して生じていることから、肺胞マクロファージにおけるRegnase-1欠損がCTD-PAH病態を引き起こしているものと推察されました。
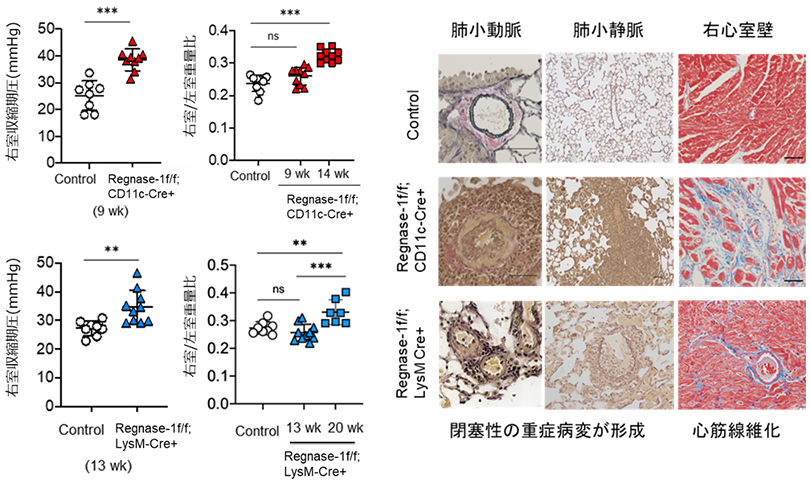
図2. Reganase-1を骨髄系細胞で欠損させた2系統のマウスはPHを自然発症し、重症の肺血管病変が肺動脈のみならず肺静脈にもみとめられる。さらに、心筋の線維化も合併していることから、重症のCTD-PAHを再現する新規PAHモデルマウスであると考えられる。
次に、Regnase-1欠損マウスの肺胞マクロファージと肺動脈でのトランスクリプトーム解析により、Regnase-1欠損マウスで上昇した遺伝子群の中からRegnase-1によって直接制御される遺伝子を絞り込み、IL-1α、IL-6、PDGFa/bなどの遺伝子がRegnase-1によって分解制御されることが明らかとなりました。そこで、Regnase-1欠損マウスを用いて、上記因子の阻害実験を行ったところ、IL-6及びPDGFを阻害することでPAH病態の改善が見られました。以上の結果より肺胞マクロファージにおけるRegnase-1はIL-6、PDGFのmRNA分解を介してPAH病態を負に制御しているということが明らかになりました(図3)。
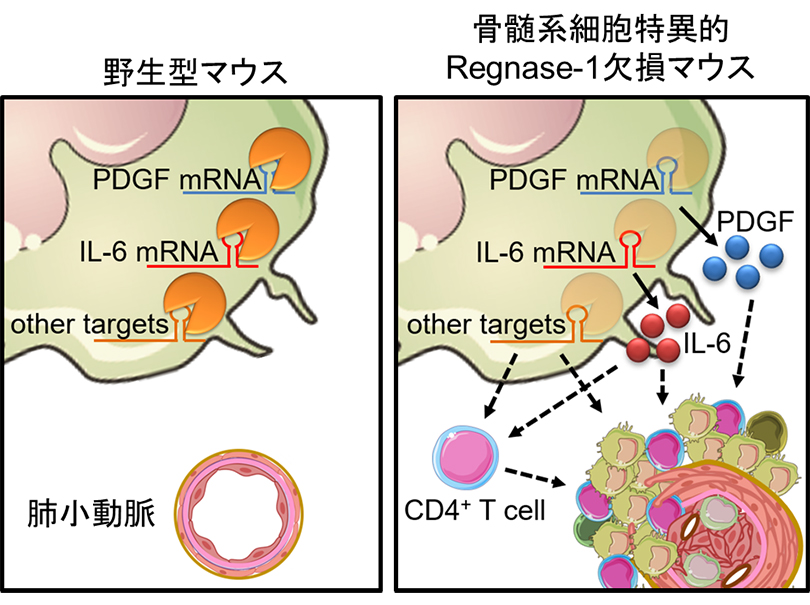
図3. 肺胞マクロファージにおけるRegnase-1がIL-6やPDGFのmRNAの分解を介してPAH病態を負に制御する
本研究で作製したRegnase-1欠損マウスは、既存のPAHモデルマウスで再現することのできなかった重症PAH患者の肺動脈病理像を再現し、CTD-PAH患者に合併することの多い肺静脈閉塞症や心臓線維化の病理像も見られて、重症PAH、特にCTD-PAHの病態解明に有用な新規のモデルマウスだと考えられます。今後、このマウスを用いて膠原病性PAHの病態解明が更に進展すると期待されます。既存の血管拡張薬では、肺動脈構成細胞の異常な細胞増殖を制御することはできず、新しい治療薬の開発が望まれています。今回、炎症とPAHの関係に着目し、Regnase-1が炎症を抑制する中核となりPAH病態を制御するということを基礎実験と臨床データの両方を用いて示しました。今後はRegnase-1の発現量や機能を薬剤的に制御する手法を開発するとともに、PAHの新規治療につなげていきたいと考えています。
著者コメント
本研究は京都大学医学研究科医化学講座の大学院生夜久愛先生、竹内理教授らとの共同研究です。肺高血圧症の基礎研究での重症PAHモデルとしては、ラットでSugen5416と低酸素を負荷するSu/Hxモデルが、これまでのゴールドスタンダートでした。Regnase-1骨髄系細胞KOマウスは、低酸素も薬剤負荷もせずに自然経過で重症PAHの病態を呈し、更には全身の炎症所見も併発します。膠原病性PAHの良いモデル動物はこれまで皆無でしたが、本マウスは世界初の膠原病性PAHモデルと言え、今後のスタンダードとなることが期待されます。このマウスを用いて、PAHの病態解明、新しい診断法・治療法の開発を進めていきたいと思います。
また、2022年度からAMED難治性疾患実用化研究事業の病態解明(研究代表者:中岡)で採択されており、今後も更に研究を進めて、臨床に還元できる様に努力していきたいと思います。血管生物医学会の学会員の方々におかれましては、今後もご指導・ご鞭撻のほど宜しくお願い致します。



