学会員論文紹介
近著論文の解説
血流に起因する内腔圧による血管新生の新たな制御メカニズムの発見
-創傷治癒過程で新たな血管は下流側からつくられる-
弓削進弥・西山功一・福原茂朋
対象論文
- Mechanical loading of intraluminal pressure mediates wound angiogenesis by regulating the TOCA family of F-BAR proteins
- Shinya Yuge#, Koichi Nishiyama#,*, Yuichiro Arima, Yasuyuki Hanada, Eri Oguri-Nakamura, Sanshiro Hanada, Tomohiro Ishii, Yuki Wakayama, Urara Hasegawa, Kazuya Tsujita, Ryuji Yokokawa, Takashi Miura, Toshiki Itoh, Kenichi Tsujita, Naoki Mochizuki, Shigetomo Fukuhara*(#共同第一著者、*共同責任著者)
- Nature Communications Vol. 13, 2594 (2022).
doi: 10.1038/s41467-022-30197-8
URL: https://www.nature.com/articles/s41467-022-30197-8
Profile著者プロフィール

日本医科大学 先端医学研究所 病態解析学部門

宮崎大学 医学部 機能制御学講座 血管動態生化学分野

日本医科大学 先端医学研究所 病態解析学部門
論文サマリー
血管新生とは、既存の血管から血管枝が出芽・伸長し、新たな血管網を構築する生命現象であり、個体の発生や成長、生体恒常性維持に重要な役割を担っています。例えば、創傷治癒における損傷組織の修復には、血管新生による新たな血管網の形成が必要です。しかし、糖尿病などの代謝性疾患、心血管疾患などの疾患では、血管新生の異常により創傷治癒が遅延し、疾患の病態が悪化することが知られています。そのため、これら疾患の予防法・治療法開発には、創傷治癒における血管新生の制御メカニズムの解明が重要ですが、未だ十分には理解されていません。また、血管新生の制御には、VEGF(血管内皮増殖因子)に代表される血管新生因子による化学的刺激に加え、力学的刺激(メカニカルストレス)の関与が示唆されていますが、創傷治癒過程の血管新生におけるメカニカルストレスの重要性は明らかにされていませんでした。
われわれは、創傷治癒における血管新生の制御メカニズムを明らかにするため、血管内皮細胞を蛍光タンパク質で標識したゼブラフィッシュ成魚の皮膚に損傷を加え、創傷治癒における血管新生の蛍光ライブイメージングを行ないました。すると、損傷された血管から新たな血管が伸長し、損傷された血管が修復される現象を見ることができました。興味深いことに、損傷した血管は一様に伸長するのではなく、血流に対して下流側の損傷血管が活発に伸長し血管を修復するのに対し、上流側の損傷血管はほとんど伸長しませんでした(図1)。
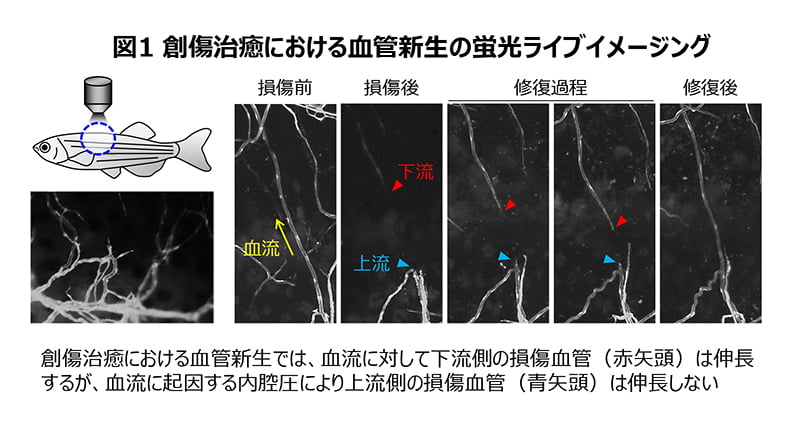
なぜ血流に対して上流側と下流側の損傷血管の伸長に違いがあるのかを探るため、微小流体デバイスを用いて体の外で血管新生を再現する試験管内モデルを独自に開発し、ゼブラフィッシュを用いた蛍光ライブイメージングと併せて解析を進めました(図2)。
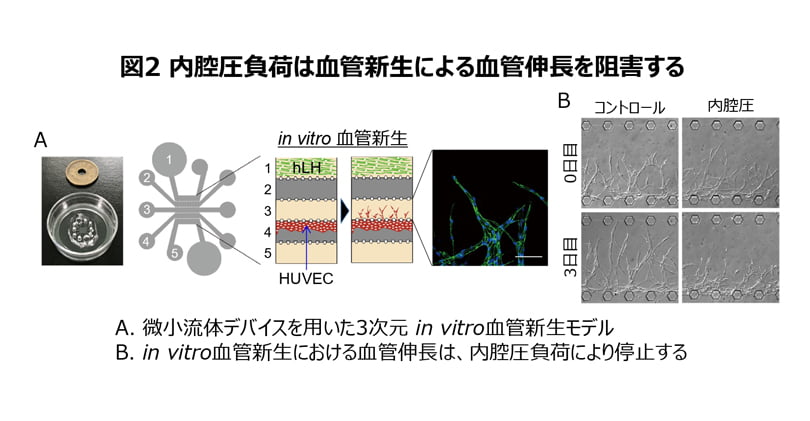
その結果、血流に対して上流側の損傷血管には、血管が損傷後も血流が流れ込み、心臓のポンプ機能が生み出す内腔圧がかかっており、この内腔圧が血管を拡張し内皮細胞が伸展されることで、血管の伸長が阻害されているメカニズムが示されました。血管新生において、血管内皮細胞は前後軸極性を形成し、先導端でのみアクチン重合を誘導することで、前方へと遊走し血管を伸長させています。われわれは、上流側の損傷血管の内皮細胞は伸展を受けることで、先導端におけるアクチン重合が抑制され、前後軸極性が消失することで、細胞遊走・血管伸長が阻害されることを見出しました。
さらに、血管内皮細胞への伸展刺激がアクチン重合を阻害する分子メカニズムについて解析を進め、TOCAファミリーに属するBARタンパク質の関与を突き止めました(図3)。
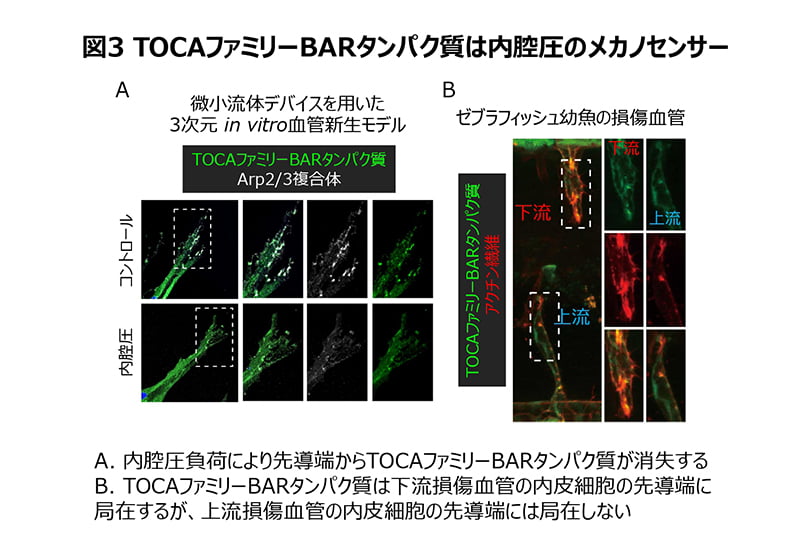
下流側の損傷血管では、TOCAファミリーBARタンパク質が血管内皮細胞の先導端の細胞膜に結合し、アクチン調節因子であるN-WASP・Arp2/3複合体を動員することで、アクチン重合を誘導し、細胞遊走を促進していることを見出しました。一方、上流側の損傷血管の血管内皮細胞では、伸展刺激により上昇した細胞膜の張力が、TOCAファミリーBARタンパク質の先導端への結合を抑制するため、アクチン重合が起こらず、細胞遊走が阻害されていることを発見しました。以上の結果から、TOCAファミリーBARタンパク質は、血管新生における内皮細胞遊走を司る重要なアクチン調節タンパク質であることが解明されました。また、TOCAファミリーBARタンパク質は、内腔圧による血管内皮細胞への伸展刺激を感知するメカノセンサーとしても機能し、創傷治癒における血管新生を制御していることが明らかになりました(図4)。
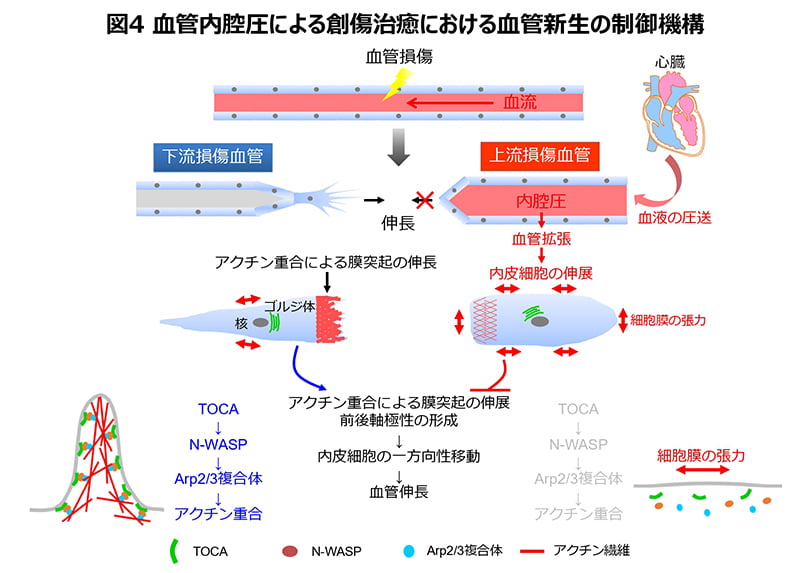
本研究により、メカニカルストレスによるBARタンパク質を介した形態形成メカニズムが、in vivoではじめて証明されました。
今回の研究において、われわれは、「創傷治癒における血管新生では、血流に対して下流側の損傷血管は伸長するのに対し、上流側の損傷血管はほとんど伸長しない」という、ライブイメージングでしか知り得ない現象を発見し、創傷治癒過程の血管新生における、内腔圧の新たな役割とその制御メカニズムを明らかにしました。今後、内腔圧により血管新生を制御するしくみの生理的な意義を解明することができれば、創傷治癒の遅延がかかわる疾患の新たな治療法の開発、さらには心筋梗塞・狭心症、閉塞性下肢動脈硬化症などの虚血性疾患に対する効果的な血管再生療法の開発につながる可能性があります。また、本発見は、がんの病態とも関連する可能性があります。がん組織には、血管新生によって、無秩序で未熟な腫瘍血管が異常に増生し、がん病態の進行や治療抵抗性に関わっています。腫瘍血管は、脆弱で透過性が亢進しており、それによりがんの組織圧が高くなっていることが知られています。このような環境下では、内腔圧による血管の拡張が抑えられ、血管内皮細胞にかかる伸展刺激は減弱していると考えられます。つまり、内腔圧による血管内皮細胞の伸展刺激の減弱が、血管新生によりがん組織の異常血管が増生している一つの原因である可能性が考えられます。したがって、がん組織の血管の内腔圧や組織圧を制御し、腫瘍血管を正常化することができれば、化学療法や免疫療法の治療効果を増強する有効な手段になると期待されます。
著者コメント
本研究は、2つの研究室で独立してはじまりました。ゼブラフィッシュを用いた蛍光イメージングにより血管研究を遂行する福原グループでは、弓削君が成魚を長時間ライブイメージングする技術を確立し、「創傷治癒における血管新生では、血流に対して下流側の損傷血管は伸長するのに対し、上流側の損傷血管は血流に起因する内腔圧によりほとんど伸長しない」という予期せぬ現象を発見しました。一方、西山グループは、微小流体デバイスを用いて血管新生をin vitroで再現できる試験管内モデルを独自に開発し、内腔圧が血管新生における血管伸長を抑制することを発見しました。ちょうどその頃の2015年秋、九州であったある研究会の後の飲み会で、お互いの発見について話をする機会があり、それがきっかけとなって共同研究がはじまりました。本研究は、この2つのグループが協働することで、はじめて実現できたと確信しています。あれから、7年以上の長い時間を要しましたが、ようやく本共同研究の成果を論文として報告することができ安心しています。
本研究の基盤となったゼブラフィッシュ成魚のイメージング技術は、弓削、福原の前任地である国立循環器病研究センター研究所細胞生物学部で樹立しました。同研究部部長(現研究所長)の望月直樹先生には多大なるご支援を頂きました。また、論文共著者の先生方をはじめとして、多くの方のサポートにより本研究成果を仕上げることができました。この場を借りて、御礼申し上げます。




