学会員論文紹介
近著論文の解説
高脂肪食を摂取したLDL受容体欠損マウスではヒストンH3のシトルリン化を介して血管内膜への好中球接着が亢進する
大坂 瑞子・吉田 雅幸
Profile著者プロフィール

東京医科歯科大学大学院医歯学総合研究科先進倫理医科学

東京医科歯科大学大学院医歯学総合研究科先進倫理医科学
論文サマリー
過剰な脂肪摂取や脂質異常症は、アテローム性動脈硬化症の危険因子です。これらの因子はアテローム性動脈硬化症を引き起こす主要なメカニズムである血管炎症と関連することがいくつかの研究によって報告されています。我々は以前の研究で、高脂肪食が野生型(wt)マウスの動脈血管内膜への好中球接着を誘導することを報告しました。しかし、wtマウスは高脂肪食摂食による病変形成に耐性があるため、アテローム性動脈硬化症の病変形成に関連する血管炎症への好中球の関与を示すことはできませんでした。さらに、アテローム性動脈硬化症においては、急性炎症において重要な役割を担う好中球の役割は十分に研究がなされていません。この研究では、アテローム性動脈硬化症に関連する血管炎症における好中球の関与を調べました。そこで、アテローム性動脈硬化症モデルであるLDL受容体欠損(LDLR-/-)マウスにおいて、好中球が高脂肪食誘発性の血管炎症にどのように寄与するかについての詳細なメカニズムを検討しました。
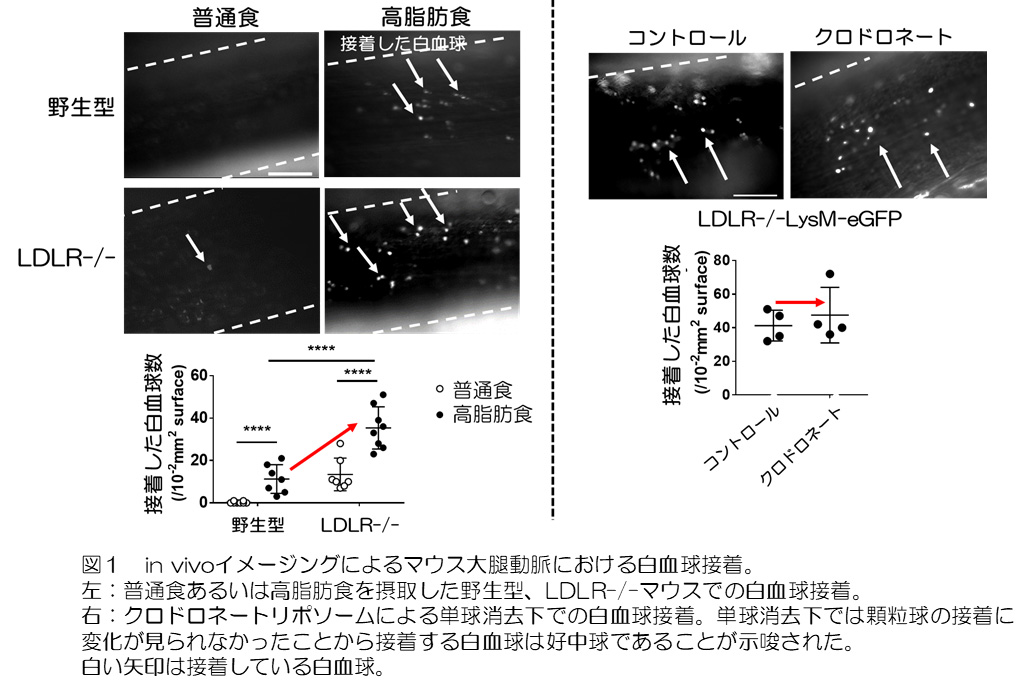
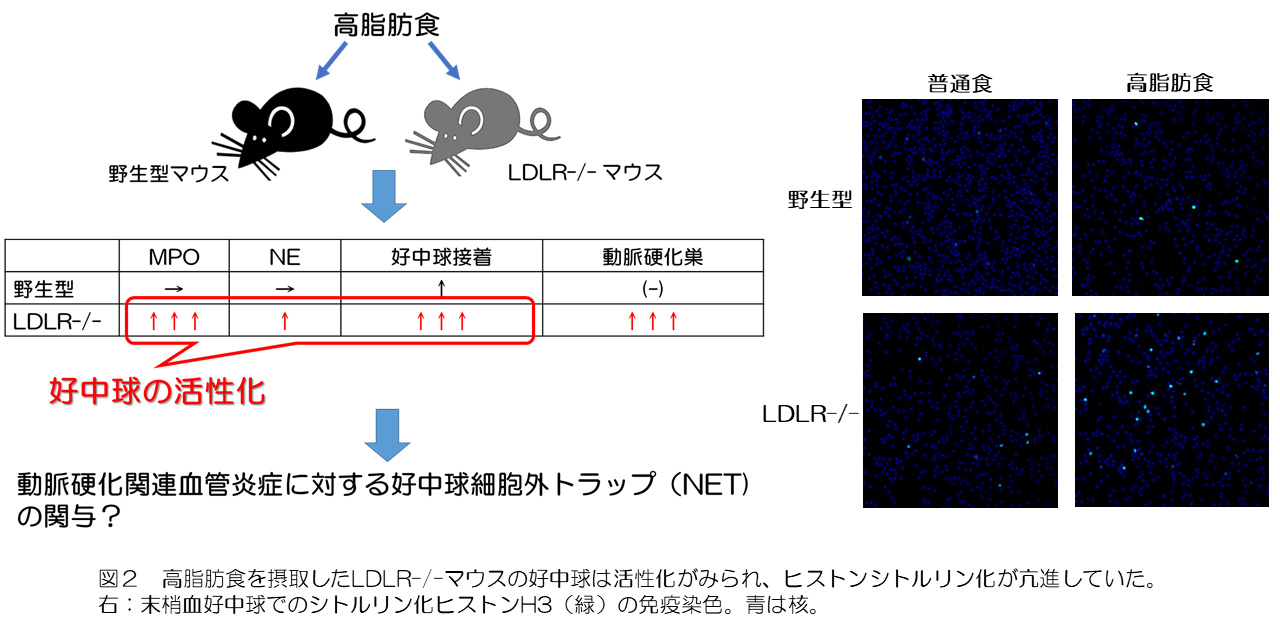
高脂肪摂取はLDLR-/-マウスにおいても白血球接着を誘導しましたが、さらにその接着数は高脂肪食を摂取した野生型マウスよりも有意に増加することが大腿動脈でのin vivoイメージングによって観察されました。また、接着する白血球分画は野生型マウスと同様に好中球であることが明らかとなりました(図1)。さらに、好中球活性化マーカーであるミエロペルオキシダーゼ(MPO)と好中球エラスターゼ(NE)の血中濃度が上昇していたことから高脂肪食を摂取したLDLR-/-マウスでは、野生型マウスより好中球の活性化がみられることが示唆され、野生型マウスとアテローム性動脈硬化症マウスの間の高脂肪食誘発性好中球活性化の違いがアテローム性動脈硬化症関連の血管炎症に影響を与える可能性があるという仮説を立てました。さらに、MPOやNEは好中球細胞外トラップ(NETs)のマーカーでもあることから、好中球接着におけるNETsの関与を検討しました。LDLR-/-マウスの末梢血好中球ではNETsのマーカーであるヒストンH3のシトルリン化が有意に亢進しており(図2)、PAD4阻害薬(TDFA)によるヒストンシトルリン化抑制下では白血球接着は有意に減少しました。一方でNETsの特徴的な形態である細胞外クロマチン構造を破壊する目的で投与したDNase1では接着抑制がみられませんでした。これらの結果から、NETsによる細胞外クロマチン構造ではなく、その前段階であるヒストンシトルリン化が白血球接着に関与することが示唆されました。また、高脂肪食を摂取したLDLR-/-マウスの血中ではCXCL1が上昇し、このことがヒストンシトルリン化を誘導することが分かりました。
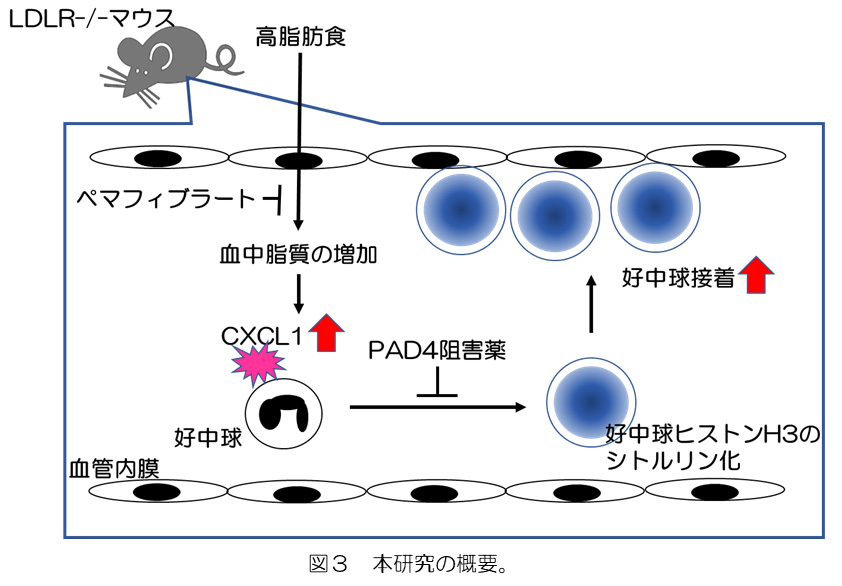
新規的ペルオキシソーム増殖因子活性化受容体 α(PPARα)モジュレーターであるペマフィブラートは、フィブラート系高脂血症治療薬です。高脂肪食を摂取したLDLR-/-マウスに対するペマフィブラート投与は好中球のヒストンシトルリン化を減弱し、血管内膜への好中球接着を有意に抑制しました。従って、ペマフィブラートはヒストンシトルリン化の減弱による抗血管炎症作用を有することが示唆されました。
今回の研究によって、CXCL1-CXCR2経路を介した好中球のヒストンH3シトルリン化がアテローム性動脈硬化症のマウスモデルの血管炎症を増強することが明らかとなり(図3)、 ヒストンH3の過剰なシトルリン化は、アテローム性動脈硬化症に関連する血管炎症の開始に重要な役割を果たす可能性が示唆されました。
所属研究室の吉田雅幸先生や東京都健康長寿医療センターの石神昭人先生にご指導やご助言をいただきながら研究を進めることができましたこと、また研究室の皆さんのご協力いただけたことをこの場をお借りして心より感謝申し上げます。
活用したデータベースにかかわるキーワード
動脈硬化症
好中球細胞外トラップ
ペマフィブラート


