学会員論文紹介
近著論文の解説
Vasohibin-1が血管新生を抑制するための新規シグナル伝達調節機構を解明
小林 美穂
対象論文
- Tubulin carboxypeptidase activity of vasohibin-1 inhibits angiogenesis by interfering with endocytosis and trafficking of pro-angiogenic factor receptors
- Kobayashi M, Wakabayashi I, Suzuki Y, Fujiwara K, Nakayama M, Watabe T, Sato Y.
- Angiogenesis. 2020 Oct 14. doi: 10.1007/s10456-020-09754-6. Online ahead of print.
PMID: 33052495
Profile著者プロフィール

東京医科歯科大学大学院 医歯学総合研究科 硬組織病態生化学分野
論文サマリー
研究の背景
病的な血管新生は、腫瘍の成長や粥状動脈硬化、及び糖尿病性網膜症を含む様々な生活習慣病において疾患の進行に寄与することが分かっています。これら病的な血管新生を引き起こす主な促進因子としては、血管内皮細胞増殖因子(VEGF)や線維芽細胞成長因子-2(FGF2)がよく知られており、特に最も強力な促進作用を持つVEGFに対する抗血管新生療法が多く開発され、VEGFブロッカーとして治療に応用されています。ところが、VEGFブロッカーには正常血管への障害や薬剤耐性誘引の問題があるため、これらのような副作用を示さない新しい抗血管新生治療法の開発が待ち望まれています。
一方、vasohibin-1(VASH1)はVEGFやFGF2を始めとした多くの血管新生促進刺激に反応した血管内皮細胞で発現が上昇する遺伝子であり、培養血管内皮細胞やマウス生体内において血管新生を抑制して、腫瘍の進展を抑える機能があります。さらにVASH1は、血管内皮細胞が受けるストレスに対する耐性を向上させて、強く健やかな血管を維持する機能も持ちます。このようにVASH1はこれまでの抗血管新生療法が持つ問題点を克服するために利用できる可能性がありましたが、どのような細胞内制御機構を通して血管新生を抑制するのか、その詳細な仕組みが不明であったために、創薬ターゲットとするには困難でした。
研究成果の概要
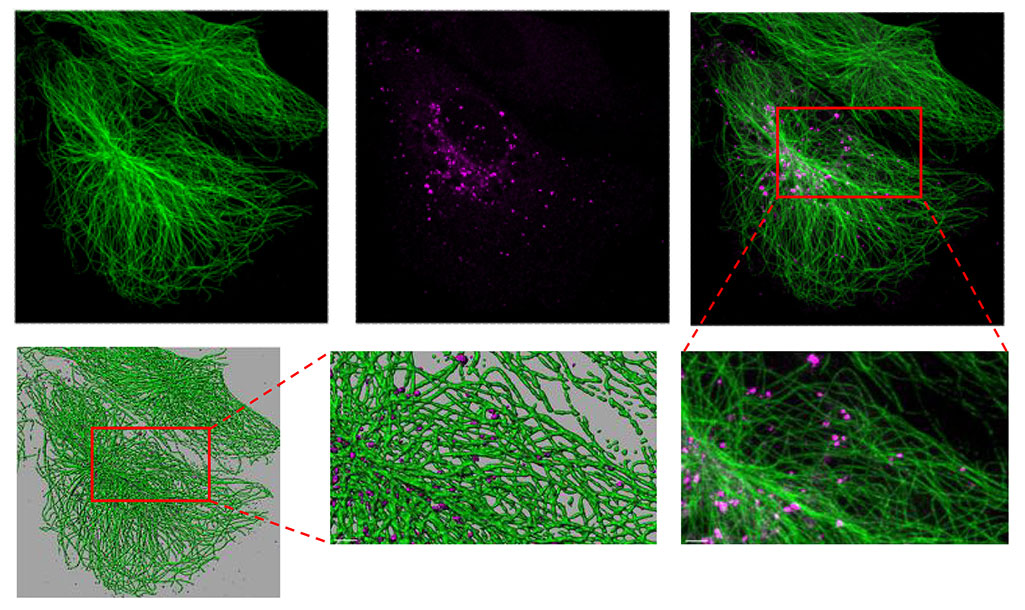
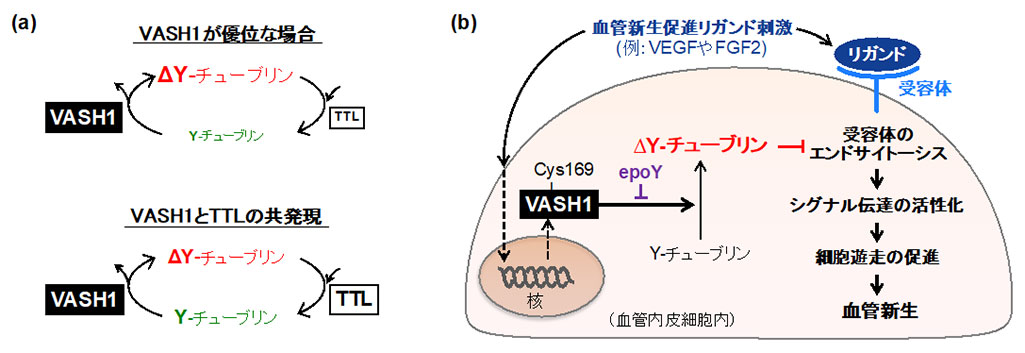
近年、VASH1が微小管の翻訳後修飾である脱チロシン化を誘導する酵素活性を持つことが報告されましたが、VASH1による微小管脱チロシン化の生物学的な役割については不明な点が多く残されていました。今回私たちは、VEGF刺激に応じて血管内皮細胞内でVASH1が産生されるのに伴い、脱チロシン化型チューブリン(ΔY-チューブリン)が増加することを見出しました。さらに、VASH1と共に微小管を再チロシン化する酵素であるチューブリンチロシン化酵素(TTL)を作用させることによって、VASH1により増加したΔY-チューブリン量を通常レベルと同程度にまで戻すことができました。このことから、VASH1は血管内皮細胞のΔY-チューブリン量を過剰に増加させ、細胞内チューブリンのΔY/YレベルのバランスをΔY側に偏らせると考えられました(図a)。VASH1によって血管内皮細胞内のΔY-チューブリンを増加させると、VEGFに誘導される血管内皮細胞遊走やシグナル伝達の活性化、さらに生体内での血管新生が抑制されましたが、VASH1とTTLを共に作用させてΔY-チューブリン量をコントロールと同程度にまで低下させると、VASH1が導くこれらVEGFに対する全ての抗血管新生効果が見られなくなりました。この結果から、VASH1による抗血管新生作用にはΔY-チューブリン量の増加が必要であることが明らかとなりました。
ここで私たちが注目したのが、ΔY-チューブリン量の変化がシグナル伝達の下流部分に影響したことでした。微小管は細胞運動や極性形成において重要な役割を果たしますが、細胞内での分子輸送レールとしても機能しています。一方、VEGFやFGF2といった成長因子については、これらリガンドと結合した受容体が細胞内に取り込まれてエンドソームに運ばれることが、下流シグナル伝達の活性化に必要であることが分かっています。VASH1により血管内皮細胞のΔY-チューブリン量を増加させておくと、VEGF刺激に誘導されるVEGF受容体2(VEGFR2)のエンドサイトーシス促進作用が見られなくなりましたが、VASH1とTTLを共に作用させて細胞内のΔY-チューブリン量をコントロールと同程度にまで戻すと、VEGF刺激によるVEGFR2のエンドサイトーシスが復活しました。これらの結果から、VASH1は血管内皮細胞においてΔY-チューブリン量を増加させることで、受容体のエンドサイトーシス阻害を通してシグナル 伝達を抑制し、抗血管新生効果を発揮していることが明らかになりました。さらに、脱チロシン化酵素活性を持たないVASH1変異体の過剰発現やVASH1活性化阻害剤処理では血管新生の抑制が見られなかったことから、VASH1による抗血管新生効果には脱チロシン化酵素活性が必要であることも明らかになりました(図b)。
研究成果の意義
VEGFのみを標的とした抗血管新生療法では、薬剤耐性をはじめとした副作用が問題になっていましたが、VASH1はΔY-チューブリン量の増加を通して VEGFだけでなくFGF2による受容体のエンドサイトーシス、シグナル伝達の活性化および血管内皮細胞遊走の促進を抑制できました。VASH1のこの仕組みを応用することで、病的な血管新生が及ぼす疾患に対して、副作用が少なく効果的な新たな抗血管新生療法への導出が期待されます。また、VASH1による受容体のエンドサイトーシス阻害作用は、一般的なエンドサイトーシス作用において広く機能しているダイニンの働きに影響するものでした。そのため、VASH1によるΔY-チューブリン増加の仕組みひとつで様々なリガンド/受容体の下流で活性化するシグナル伝達を抑制できる可能性があり、将来的にはシグナル伝達の異常な活性化により引き起こされる多様な疾患に対する治療に応用できる可能性を秘めています。
著者コメント
本研究は、東北大学加齢医学研究所 腫瘍循環研究分野(佐藤靖史 教授)で主に進めたものです。私が佐藤先生の元で研究を始めた当時、鈴木康弘 助教(東北大学 同所属)が「VASH1を過剰発現させると微小管が良く染まるようになる」ということに気づかれており、そこから鈴木先生と共にVASH1が微小管の脱チロシン化を誘導することを証明し、その役割について様々な解析に取り組みました。当初、脱チロシン化についての研究は微小管の翻訳後修飾の中でもマイナーであったこともあり、学会発表でもその重要性があまり理解されずに悩んだこともありました。また、東日本大震災により作成中のアデノウィルスベクターが完成間近にダメになり作り直すなど、研究成果が出るには長い時間がかかってしまいました。おまけに、やっと論文を投稿した矢先に思いがけずヨーロッパの2つのグループからVASHがtubulin carboxypeptidaseであることがスクープされてリジェクトされてしまったことや、異動により再投稿のための実験が出来なくなるなど、この論文を世に出すまでにはとてもたくさんの困難がありました。
佐藤先生や鈴木先生、マックスプランク研究所の中山雅敬先生には厳しくも温かいご指導やご助言を頂いたこと、さらに東京医科歯科大学 硬組織病態生化学分野の渡部徹郎教授の手厚いご支援により、どうにか論文として発表することができました。心よりお礼申し上げたいと思います。また、本研究成果は多くの先生方のご協力や、学生さん達が根気強く実験を進めてくれたお陰で得られたものです。この場を借りて深謝致します。