学会員論文紹介
近著論文の解説
インターロイキン13受容体α2(IL13Rα2)が血管新生を介して悪性黒色腫(メラノーマ)を進展させるメカニズム
吉松康裕 ・ 渡部徹郎
(東京医科歯科大学 大学院医歯学総合研究科)
対象論文
- Interleukin-13 receptor α2 is a novel marker and potential therapeutic target for human melanoma.
- Okamoto H*, Yoshimatsu Y*, Tomizawa T*, Kunita A*, Takayama R*, Morikawa T, Komura D, Takahashi K, Oshima T, Sato M, Komai M, Podyma-Inoue KA, Uchida H, Hamada H, Fujiu K, Ishikawa S, Fukayama M, Fukuhara T, Watabe T. Scientific Reports 2019, 9(1):1281 (*: equal contribution)
Profile著者プロフィール

YOSHIMATSU YASUHIRO
略歴:
2010年 東京大学 大学院医学系研究科 博士課程修了 (分子病理学分野)
2010年 同 分子病理学分野 ポスドク
2014年 東京薬科大学 生命科学部 腫瘍医科学研究室 ポスドク
2015年 東京薬科大学 生命科学部 腫瘍医科学研究室 助教
2016年 東京医科歯科大学 大学院医歯学総合研究科 分子細胞機能学分野 助教
2018年 東京医科歯科大学 大学院医歯学総合研究科 硬組織病態生化学分野 講師
2019年 新潟大学 薬理学分野 准教授
研究テーマ:血管・リンパ管の形成メカニズムの解明
抱負:腫瘍脈管をターゲットとした新たながんの制御法開発および機能が低下した脈管の再生法開発をめざして研究を進めたい
研究室URL:https://www.med.niigata-u.ac.jp/pha/index.html

WATABE TETSURO
東京医科歯科大学 大学院医歯学総合研究科 硬組織病態生化学分野・教授
E-mail:
研究室URL:https://cellular-biochemistry-tmdu.net/
論文サマリー
研究の背景
悪性黒色腫(メラノーマ)は、皮膚がんの一種であり、メラニン色素を産生するメラノサイトや母斑細胞(ほくろの細胞)ががん化したものだと考えられている。悪性黒色腫は悪性度が非常に高く、早期から浸潤・転移が認められる難治がんの一つである。治療においては、がん細胞の増殖性を標的とした抗がん剤を用いた化学療法などが主流で、副作用を伴う抗がん剤が多いことが問題となっている。悪性黒色種においても分子標的治療薬の開発は進められており、BRAF遺伝子を標的としたベムラフェニブ(vemurafenib)などが用いられているが、副作用も報告されており、新たな標的分子の同定ならびに、がんの進展のメカニズムの解明が急務である。しかし、悪性黒色腫において特異的に発現し、その進展に寄与する細胞表面抗原についてはこれまで同定されていなかった。
筆者らは、これまで悪性黒色腫の新規がん抗原を同定するために、A375悪性黒色腫細胞に対する特異抗体を探索し、その抗原の一つとしてインターロイキン13受容体α2(IL13Rα2)を同定した。さらに、IL13Rα2の悪性黒色腫患者における発現パターンを検討するために、ティッシュマイクロアレイを用いて100例以上の病理標本を用いて免疫組織染色を行った結果、IL13Rα2が一部(約10%)の患者の腫瘍組織において発現していることを見出した(図1)。正常組織においてIL13Rα2は精巣にしか発現しないことが確認されたため、IL13Rα2は悪性黒色腫においてがん細胞の細胞膜に発現する新規がんマーカーであることが明らかになった。
低分子量GTP結合タンパク質の一つであるRap1は、細胞内シグナル伝達に関わる分子で、インテグリンを活性化することで、細胞と細胞外マトリックスの接着を増強するとともに、カドヘリンを介した細胞同士の接着も促進します。本研究では、Rap1がインテグリン接着を促進することで血管芽細胞と体節細胞の接着を増強し、造血幹細胞の発生を制御していることを明らかにしました。
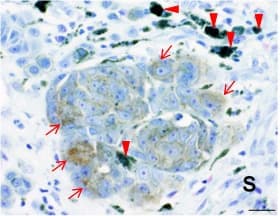
図1 悪性黒色腫におけるIL13Rα2の発現
悪性黒色腫組織を用いたIL13Rα2に対する免疫染色(茶色:赤矢印)。IL13Rα2の発現はがん細胞のみに限局し、間質(S)においては検出されなかった。赤矢頭:メラニン色素。スケールバー: 20 μm
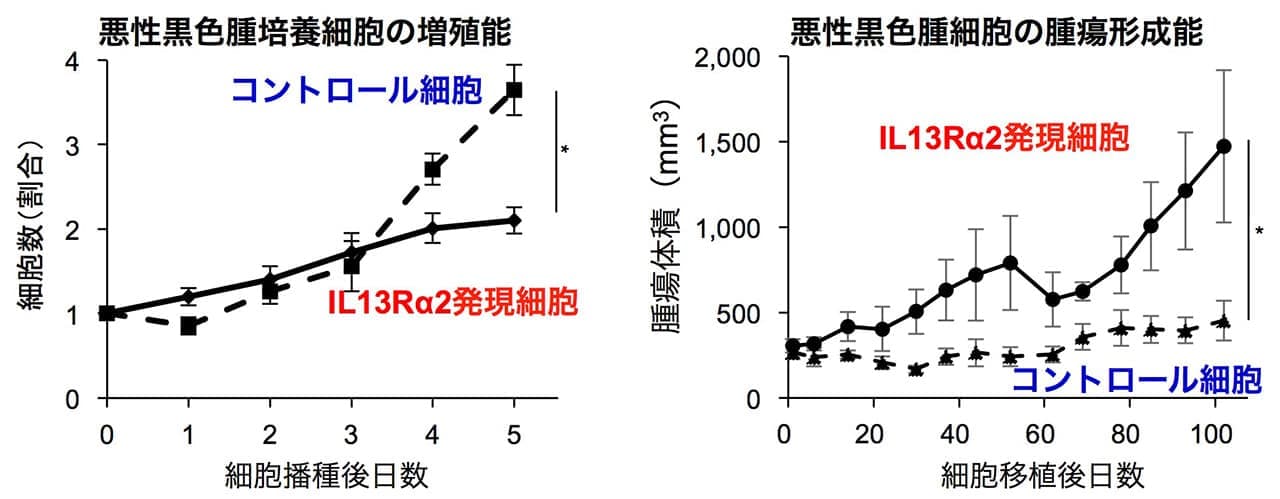
次に筆者らは、IL13Rα2が悪性黒色腫の進展に果たす役割を検討するために、IL13Rα2を発現していないSK-MEL-28悪性黒色腫細胞にIL13Rα2を発現させて(IL13Rα2発現細胞)、発現していないSK-MEL-28細胞をコントロール細胞として、がん細胞の増殖ならびに腫瘍形成能を比較した。その結果、培養細胞レベルではIL13Rα2発現細胞の増殖はコントロール細胞と比較して低かったが、免疫不全マウスの皮下に移植して形成される腫瘍の大きさを比較したところ、IL13Rα2発現細胞は腫瘍形成能が高くなるという結果が得られた(図2)。また、この作用はIL13Rα2を発現するA375悪性黒色腫細胞においてIL13Rα2遺伝子を欠損させても同様に観察された。
図2 悪性黒色腫の進展におけるIL13Rα2の役割
L13Rα2を発現していないSK-MEL-28悪性黒色腫細胞(コントロール細胞)とIL13Rα2を発現させた細胞(IL13Rα2発現細胞)を培養し細胞数を計測したところ、IL13Rα2発現細胞の増殖能は低いことが示されたが、マウスに移植して腫瘍体積を測定したところ、IL13Rα2発現細胞の腫瘍形成能が高いことが明らかとなった。この作用の違いは腫瘍組織におけるがん細胞以外の間質(血管など)に依存することが考えられた。
がん微小環境においては、がん細胞以外に血管や線維芽細胞など、腫瘍形成を亢進する作用を持つ構成因子が存在する。特に血管はがん細胞の増殖に必要な酸素や栄養を供給することにより、腫瘍組織の増大に必須の役割を果たしていることから、筆者らはIL13Rα2の腫瘍形成能に対する作用が血管新生を介している可能性を検討するために、悪性黒色腫細胞由来の腫瘍組織における血管新生を血管内皮細胞マーカーであるPECAM-1に対する抗体を用いて計測した。その結果、IL13Rα2発現細胞由来の腫瘍組織における血管の量はコントロール細胞由来の腫瘍と比較して上昇していることが示された。そこで、筆者らはIL13Rα2の発現により悪性黒色腫細胞において血管新生を誘導する因子を網羅的に探索し、Amphiregulinという上皮細胞増殖因子(EGF)ファミリーの因子の発現がIL13Rα2により誘導することを見出した。さらに、悪性黒色腫細胞においてAmphiregulin を発現させることで腫瘍形成能と血管新生能が上昇することを見出すことにより、IL13Rα2が悪性黒色腫細胞において血管新生因子であるAmphiregulinの発現上昇を介して、血管新生を亢進させ、腫瘍形成が上昇することが示唆された(図3)。
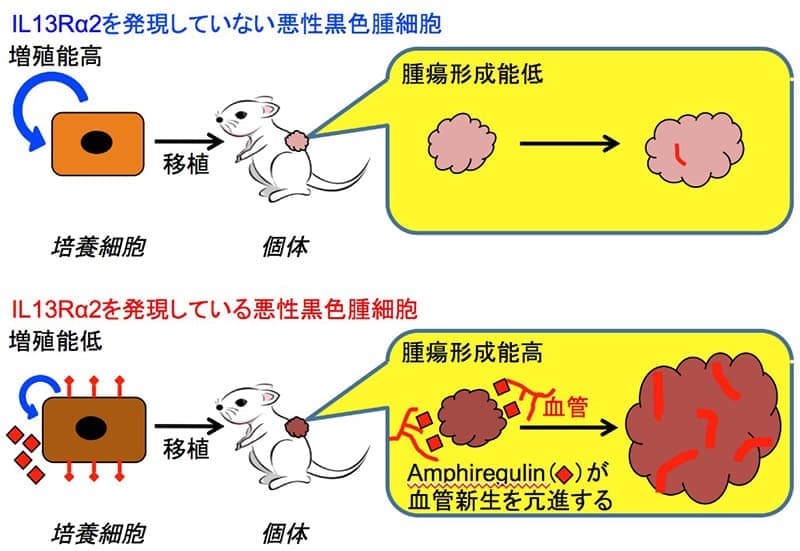
図3.本研究のまとめ
IL13Rα2を発現していない悪性黒色腫細胞(上)は増殖能は高いが、腫瘍形成能は低いのに対して、IL13Rα2を発現している細胞(下)の増殖能は低いが、Amphiregulinを発現しているため、血管新生を介して腫瘍形成能は高くなる。
本研究により、IL13Rα2が悪性黒色腫の新規バイオマーカーとして有用であることが初めて明らかとなった。IL13Rα2は正常組織においては男性の生殖臓器(精巣)においてしか発現しておらず、他のがん種(悪性神経膠腫や膵がんなど)においても発現していることから、細胞のがん化とともに発現が上昇するがんマーカーであると考えられる。そこで筆者らが本研究に先立って樹立した特異抗体などを用いたIL13Rα2を標的とした新規分子標的治療の開発が期待される。また、IL13Rα2を発現した悪性黒色腫においては、Amphiregulinなどの血管新生因子の発現上昇を介して腫瘍形成が進展することが明らかとなったため、IL13Rα2の作用を阻害することで悪性黒色腫の進展を抑制できる可能性が開けた。
著者コメント
本研究は、東京薬科大学生命科学部 腫瘍医科学研究室初代教授・濱田 洋文先生らが新規がん抗原の探索を目的として、A375悪性黒色腫細胞に対する特異抗体を同定したところ、新規抗原としてインターロイキン13受容体α2(IL13Rα2)を発見したことに始まりました。2代目教授として着任した渡部徹郎先生のご助言の下、IL13Rα2の悪性黒色腫細胞における役割を解析したところ、細胞培養では抑制的に働くという最初の仮説とは逆の結果になりましたが、「なにか別のメカニズムが隠されている」と考え、免疫不全マウスに移植したところ、やはりIL13Rα2を高発現する細胞の方が造腫瘍性が高かったため、興味深い結果が得られました。東京大学大学院医学系研究科 人体病理学分野の国田朱子先生らのご協力で、悪性黒色腫に関する、臨床的にも重要なデータが得られ、分子標的治療の可能性が期待できる結果が得られたことを嬉しく思います。本研究成果は多くの先生方の協力なしには得られなかったため、この場を借りて心より感謝申し上げます。
活用したデータベースにかかわるキーワード
IL13受容体
腫瘍血管新生
メラノーマ