学会員論文紹介
近著論文の解説
心不全は自然免疫記憶を介して多臓器合併症を促進する
中山幸輝 藤生克仁
東京大学医学部附属病院循環器内科
対象論文
- Heart failure promotes multimorbidity through innate immune memory
- Yukiteru Nakayama, Katsuhito Fujiu, Tsukasa Oshima, Jun Matsuda, Junichi Sugita, Takumi James Matsubara, Yuxiang Liu, Kohsaku Goto, Kunihiro Kani, Ryoko Uchida, Norifumi Takeda, Hiroyuki Morita, Yingda Xiao, Michiko Hayashi, Yujin Maru, Eriko Hasumi, Toshiya Kojima, Soh Ishiguro, Yusuke Kijima, Nozomu Yachie, Satoshi Yamazaki, Ryo Yamamoto, Fujimi Kudo, Mio Nakanishi, Atsushi Iwama, Ryoji Fujiki, Atsushi Kaneda, Osamu Ohara, Ryozo Nagai, Ichiro Manabe, Issei Komuro
- DOI:10.1126/sciimmunol.ade3814
- URL:https://pubmed.ncbi.nlm.nih.gov/38787963/
Profile著者プロフィール

東京大学医学部附属病院循環器内科

東京大学医学部附属病院循環器内科
論文サマリー
高齢化社会において心不全患者はますます増えています。心不全を一度発症すると、何度も入退院を繰り返して、多臓器合併症を伴います。さらに、階段状に身体機能が低下するため、介護負担も大きくなり、医療経済的にも非常に大きな課題となっています。心不全はあらゆる心血管病の終末像であり、様々な臓器でも合併症を呈し、その横断的な病態の背景には慢性炎症があると言われています。ただし、なぜ臓器で炎症が持続するのかについては分かっていないことが多いのが現状です。
心臓の間質には多くのマクロファージが存在し、出生時から心保護的な役割を担っていることが分かっており、我々も報告してきました。心不全になると、血中単球が心臓に浸潤し、心臓マクロファージに分化すると考えられていますが、重症心不全になると、ほぼ単球由来のマクロファージとなり、炎症性表現型を取るため、それ自体が病態増悪の原因になっています。そこで、心不全になること自体が、単球、マクロファージへの分化様式、表現型を変えているのではないか、さらには免疫細胞の大元である骨髄の造血幹細胞に注目し、心不全になると、その性質が変わることで全身における免疫反応が変わるのではないかと考えました。
心不全になったマウスの骨髄を移植すると、4~6か月後にレシピエントマウスの心臓間質が徐々に線維化し、左室収縮能が低下することが分かりました(図1)。慢性期の変化であることから、造血幹細胞(HSC)レベルで原因があると考えられ、心不全マウスのHSC由来の免疫細胞のプロファイルを見ることとしました。コントロールマウスと心不全マウスのHSCを採取、それぞれ移植後に、ドナー由来の心臓マクロファージの一細胞発現解析を行いました。すると、心不全になったマウスのHSCから分化した心臓のマクロファージのトランスクリプトームは、正常マウスのHSC由来の細胞と比較して、炎症性単球に近い、炎症性表現型を取る割合が多いことが分かりました(図2)。このことは、腎臓や骨格筋でも同様のことが起きており、他の臓器における心不全合併症の原因になり得ることが分かりました。
続いて、心不全HSCにどのような変化が起きているのか、網羅的発現解析、エピゲノム解析(ATAC-seq)を行ったところ、いずれも有意にTGFβシグナルの低下を認められました。TGFβはHSCの未分化維持に重要なサイトカインの一つであり、骨髄内の交感神経周囲のシュワン細胞が活性化を制御していると言われています。そこで、骨髄内の交感神経活性を免疫染色で観察すると、心不全になるにつれて、骨髄内の交感神経が減少することが分かりました。これによって活性型TGFβ量が減少することが分かり、TGFβ阻害薬の投与によって、心不全HSCと同じような分化様式を示すことが分かった。
このように骨髄に存在するHSCレベルで心不全になったという記憶が刻まれて、全身性に炎症を引き起こしやすくなるのには、骨髄に分布する自律神経、交感神経が減ることに起因することが分かりました。心不全は心臓だけの病気というわけではなく、造血という、免疫細胞の大元のレベルで変化し、全身で慢性炎症を引き起こしやすくなることが分かりました。つまり、一度心不全を発症すると、繰り返しやすくなり、様々な臓器障害が引き起こされます(図3)。造血幹細胞がなぜ変わるのかについては未解明な部分もあり、骨髄の構造をより詳細に解析しています。さらに心不全になる前から、なりやすい人、なりにくい人が免疫の状態から示唆されることが分かりました。今後も心不全予防、再発予防を目指す研究を進めたいと思います。
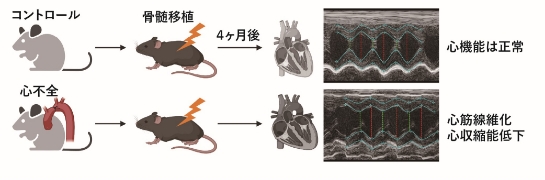
図1
図1. 心不全マウス(TAC術後4週間)とコントロールマウス(sham群)の骨髄をそれぞれ移植されたマウスを4か月後に観察すると、心不全移植群で心機能が低下し、心筋が線維化していた。作図はbioRender.comにより作成。
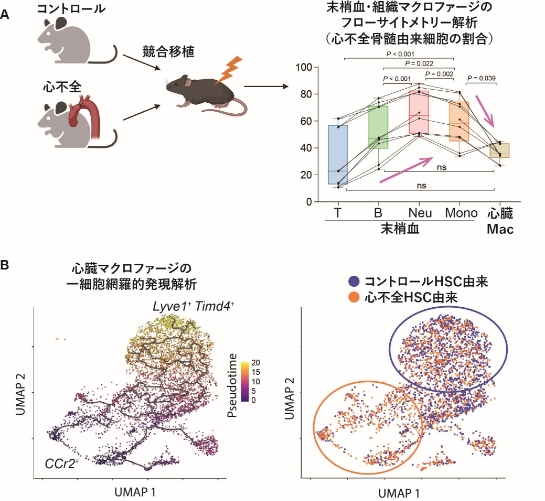
図2
図2A. 異なるgenotypeを持つ、心不全マウスとコントロールマウスからそれぞれHSCを採取し、レスキュー細胞と共にレシピエントに移植し、末梢血造血細胞と心臓マクロファージにおいて、フローサイトメトリーを用いてどちらの由来細胞であるか解析した。骨髄球系細胞においては心不全マウス由来のものが有意になるのに対して、心臓マクロファージでは割合が減っていた。作図はbioRender.comにより作成。
図2B. 同様の競合移植後の心臓マクロファージの一細胞発現解析を行った。Monocle3でtrajectory解析をすると、Ccr2+マクロファージからLyve1+Timd4+マクロファージ方向への分化が示された。Ccr2+マクロファージ側では心不全マウス由来(オレンジの円)Lyve1+Timd4+マクロファージ側ではコントロールマウス由来(青の円)が優位になっていた。
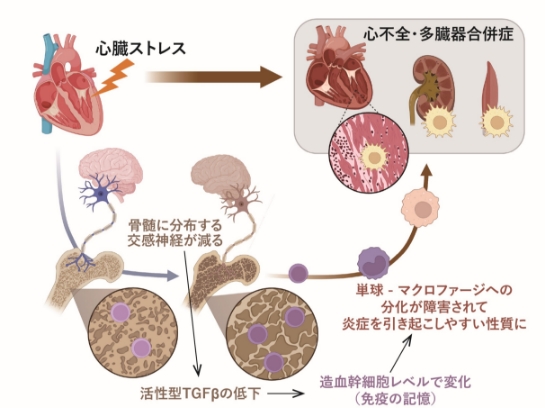
図3
図3. 心臓に心不全ストレスが加わると、骨髄中の交感神経活性が低下し、HSCの造血ニッチにおいて活性型TGFβの発現が低下する。これによって、HSCの分化様式が変わってミエロイドシフトするとともに、分化した組織マクロファージの表現型が炎症性になることで、さらなる心不全、多臓器合併症の病態形成を引き起こす。作図はbioRender.comにより作成。
著者コメント
クローン性造血や後天的Y染色体喪失が心血管病のリスク因子になることが報告されている通り、造血異常が心不全の原因になることは最近10年の間に注目される分野となりました。それぞれ、造血幹細胞レベルの遺伝子、染色体異常が単球、組織マクロファージに分化する過程で炎症性の表現型を取ることが病態機序と言われています。このような、遺伝子変異を伴わずとも、心不全ストレスが骨髄の造血ニッチの構造的リモデリングを伴うことによって、エピジェネティックな点で特定の造血幹細胞サブポピュレーションが主流になるという仮説を立てて行いました。心不全も含めた様々な生活習慣病の病態基盤にある慢性炎症の分子機序として、自然免疫記憶が挙げられます。造血幹細胞レベルでのエピジェネティックな変化が、自然免疫系の応答性を上げて、外的ストレスに対する組織のホメオスタシスを破綻させると考えられています。近年、老化や脳卒中など、いくつかのストレスモデルで同じ文脈で報告がなされている一方で、造血幹細胞での自然免疫記憶を引き起こす分子機序は一つではないようで、モデルによって異なるようです。今回の研究によって、免疫系の摂動というだけではなく、交感神経支配の制御破綻など、さらなる研究の発展に繋がる知見が得られたことは大きかったです。
今後は、心不全になると免疫の状態がどのように変わるのか、脳・自律神経の状態がどうなっているのか、マウスモデルとヒトの症例の両方で解析していくことを目指しています。シングルセルでのマルチオーム解析や、新しいフローサイトメトリーを用いた細胞画像解析、アデノ随伴ウイルスを用いた神経への介入実験に加えて、新しいセンサー技術を用いた病態解析を通じて、これまでにない心不全の評価・治療に繋がる研究を目指しています。
活用したデータベースにかかわる
キーワード
心不全
造血幹細胞
自然免疫記憶


